

高效液相色谱技术最早应用于药物领域,包括效能/纯度/性能分析、药物(代谢)动力学/生物分析测试、纯化、高通量筛选(HTS)、过程控制(IPC)监测和质量控制(QC)测试。制药行业是HPLC的主要应用市场,同时也是HPLC向更高通量和更优性能发展的主要驱动力。本文简要回顾了过去十年影响药物分析发展的HPLC的重大进展。讨论的主题如下,部分项目体现在一个典型的时间轴上,如图1所示。
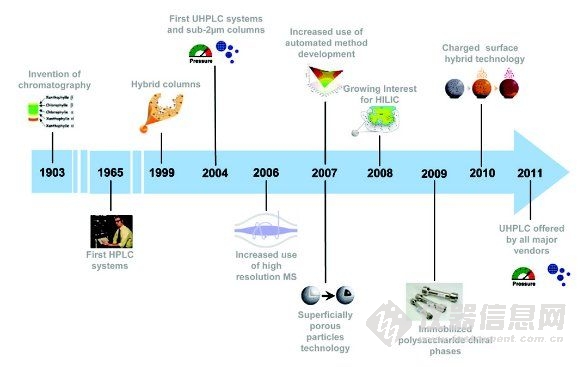
图1 过去十年中影响药物分析发展的HPLC技术进展(部分项目)
本文的目的是为繁忙的制药科学家提供一个简洁又全面的HPLC的重要的技术进展,每个主题都有实际使用过程中的便利和应用的简短描述,从用户的角度的评论,以及主要参考文献(略)的支撑。
超高压液相色谱(UHPLC)
UHPLC的革命性创新始于1997年James Jorgenson教授在概念验证方面的研究,紧接着第一个商业化系统于2004年推出。今天,从HPLC到UHPLC的转化大部分都是由主要制造商完成,这些制造商目前都可以供应某种类型的UHPLC产品。UHPLC系统、柱子以及应用的详细综述在其他地方都可以看到。UHPLC在药物分析领域的基本原理、优势、潜在的问题和最佳应用都有充分的文件记录。
表1概述了UHPLC的突出特点和优势。注意,较高的系统压力允许使用更小的微粒填充的柱子(如亚2μm)得到更快的分析速度(图2)或复杂样品更出色的分离(图3)。由于使用改良的进样器,内径较小的管路系统(< 0.005英寸),更小的紫外检测器流动池(0.5 - 2μL),所有的UHPLC都有比较低的系统扩散(4σ时,~10-20μL)。比较典型的应用是内径为2.1–3.0mm的柱子,填充物为亚2μm或亚3μm颗粒。其他重要的系统特征包括更小的系统死体积(0.1-0.3 mL)和更快的检测器响应/数据采集速率(>40 pt/s),以实现高通量的应用。
表1 UHPLC的突出特点和优势
|
UHPLC的系统特点 |
范围和评论 |
|
最高压力限制 |
15000到19000psi(1000到1250bar),流速2-5mL/min.兼容传统的和亚-2微米颗粒的色谱柱。 |
|
低系统色散 |
根据仪器配置,仪器带宽5-20μL(4σ),使用较小的连接管(<0.005"I.D)和小UV流通池(0.5-2μL),减小系统频带展宽。兼容ID低至2-3mm的色谱柱。 |
|
低的梯度保留体积 |
100-400μL(对于四元液相泵会更高),兼容高通量筛选(HTS)。小的保留(混合)体积可能影响UV检测器噪声。 |
|
其他 |
HTS快速的注射周期(-20s)和检测响应,以及高的采集率(>40pt/t),兼容目前的HPLC方法需求(如流量范围、柱温箱尺寸、进样环路) |
|
UHPLC的优势 |
评论 |
|
高通量 |
在保持相似分辨率的情况下,与传统的HPLC方法相比通量提高3-10倍。如纯度分析5min(UHPLC)/20min(HPLC)。 |
|
快速方法开发 |
短色谱柱,快速分析是色谱柱和流动相快速筛选及方法优化的理想选择。 |
|
高分辨 |
相对于HPLC,分辨率提高3倍,比如峰容量(Pc)400-600(HPLC为200) |
|
溶剂节省 |
分析时间短,使用较小ID的色谱柱,相比HPLC溶剂节省5-15倍。 |
|
高灵敏度 |
质量灵敏度增加3-10倍(样品注入量减少)。长路径UV流通池(50-60min)可以将浓度灵敏度提高6倍。 |
|
高精度 |
保留时间(2-3倍)和峰面积精密度(<1%RSD,进样体积>1μL )显著增加 |
|
可以与其他的方法联用 |
UHPLC兼容高温LC,2D-LC或者核壳色谱柱(单一或者组合联用)。这些都是可选项,而不是“有它就不能有它”。 |
与传统的HPLC相比,UHPLC具有分析速度快的优势,图2阐述了一种药物分析由HPLC方法转移为UHPLC方法的谱图对比。从HPLC到UHPLC,根据几何尺寸按比例缩放色谱柱及操作参数,可以在相同分辨率的情况下将分析时间减少10倍,这并不罕见。“保证好的分辨率的情况下进行更快的分析”这是大多数用户考虑购买更昂贵的UHPLC设备的主要诱因。
UHPLC的另一个重要的好处是其对复杂样品优秀的分离能力。这方面常常被忽视,在文献中也很少报道。在合理的时间跨度(~1 h)内,400至1000范围内的峰容量(PC)已经通过使用UHPLC来证实。峰容量是分辨率为1.0时,色谱图上可以分辨的色谱峰个数;通常传统的HPLC为200左右。有史以来第一次,UHPLC可以在单一维度,对复杂的药品、天然材料、和其他困难样品基质提供更有效的分析。图3a和3b通过两个应用 (植物提取物和胰蛋白酶的消化蛋白质)来说明Pc>300时,当前UHPLC的高分辨分离能力。
UHPLC的其他优势包括溶剂节省(5-15倍),增强的质量灵敏度(3-10倍),以及在保留时间(2–3倍)和峰面积(<0.1%RSD)方面的卓越性能。注意,有关UHPLC中UV检测灵敏度增加的报告往往会产生误导,因为质量敏感度(分析物注入量)主要与柱的空隙体积有关。通常,UHPLC不会增加浓度灵敏度(最理想的一种灵敏度),因为我们不能希望使用小的流通池来增加信噪比,除非延长流通池的路径长度 (如60毫米)。泵混合而导致的粘性发热、基线扰动以及方法转移等潜在问题已经有文献描述,而且这些问题分别也是与特定的仪器相关联的。一般来说,这些技术问题已经研究得比较清楚了,而且通过选择合适的系统配置(如混合器体积)能够很容易地减轻。但是, 由于培训、与验证数据系统的兼容性和其他方法转移的问题,UHPLC在QC实验室的应用仍然比较浪费时间。
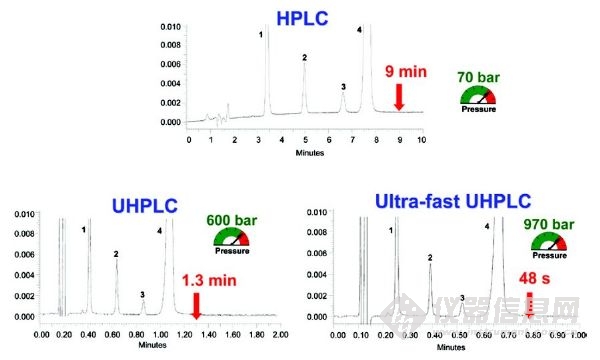
图2 以商业制药配方(Rapidocain) 质量控制分析为例:从传统的HPLC到UHPLC使用几何比例缩放。峰识别:1:对羟基苯甲酸甲酯,2:2、6-二甲基苯胺,3:尼泊金丙酯,4:利多卡因。HPLC条件:色谱柱RP18 150 x4.6毫米,5μm, F=1ml/min, Vinj=20μL。UHPLC条件: 色谱柱RP18 x2.1 50毫米,1.7μm,F = 600μL /min,Vinj = 1.4μL。超快UHPLC条件:色谱柱RP18 x2.1 50毫米,1.7μm,F = 1000μL /min,Vinj =1.4μL[16]。
我们经常听到一些争论,UHPLC也许并不需要,因为其他方法(高温LC、核壳柱子或二维LC)可以更合算的提高速度或分辨率。这种推理并不是真实有根据的,因为与传统的HPLC相比,UHPLC在使用过程会中可以与一个或多个以上的这些方法联用获得更出色的结果。这些方法都是可选项,而不是“有它就不能有它”。此外,“UHPLC”这个词语可能在几年内最终消失,因为所有新的HPLC都是UHPLC了。
HPLC色谱柱和固定相的发展
HPLC色谱柱是色谱系统的核心。在碱性分析物分析方面,制药业一直是HPLC色谱柱向高速、高分辨率、更好的峰形发展的主要驱动力。此外,QC实验室已经被要求改进色谱柱的批次重现性。从70年代到90年代,在填充材料的标准颗粒尺度(10-3μm)的逐级缩小方面已经有稳定的改进。80年代后期,高纯度B型硅材料(低金属含量)的引入是一个巨大进步,减少了硅醇的活性,并在批次间的一致性方面有重大改进。现在高纯硅的使用是所有现代硅胶基质色谱柱的标准。
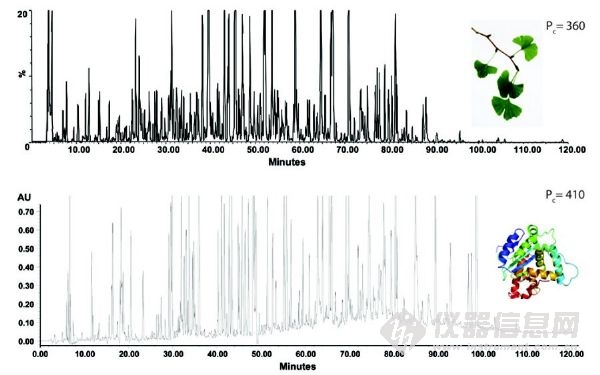
图3 UHPLC 高分辨率分离(C18色谱柱,填充亚2μm颗粒)。(A)银杏标准化提取物的色谱图。梯度:5%到40%的乙腈,120分钟,T=30°C, Lcol = 300mm,F = 0.2 mL/min,ΔPmax = 860 bar,峰容量可以达到360;(B)三种蛋白质的结合胰蛋白酶消化酶的色谱图。梯度:5%到60%的乙腈,120min ,T=30°C,Lcol = 40cm,F = 0.16 mL/min,ΔPmax = 940bar,峰容量可以达到410。
HPLC色谱柱技术的近期进展已经被广泛地综述(已经有很多文献综述并讨论了HPLC的色谱柱技术的近期进展)。表2总结了重大行业使用率较高的,用于提高生产力、稳定性、选择性或保留时间(亚2μm,核壳粒子,混合物,新奇的键合反应,HILIC)或专业应用 (手性化合物或生物分子)的色谱柱。
表2 影响药物分析的重要的HPLC色谱柱的研究进展
|
HPLC色谱柱重要研究进展 |
评论 |
|
亚2μm颗粒 |
全孔亚2μm颗粒产生较低的塔板高度和高的塔板效率。10多家供应商提供超过80种可用的化学反应,包括离子交换、尺寸排阻等。 |
|
亚3μm核壳颗粒 |
表面多孔型亚-3μm颗粒在低柱压条件下提供改善的质量传递和较低的塔板高度。增加了在药物分析中的使用案例。 |
|
混合硅颗粒 |
创新的颗粒提高色谱柱的化学稳定性(扩大pH范围、温度和压力性能,亲硅醇基活性) |
|
新奇的键合化学反应 |
多官能团的硅烷化学、极性嵌入式键合相、五氟苯酚(PFP)、 苯基-己基、表面带电杂化(CSH)相,提供“正交”分离和增强的选择性(与传统的C18键合相相比) |
|
亲水作用色谱(HILIC) |
反相色谱的“正交”分离对强极性化合物和次生代谢物有用 |
|
用于手性分离的多糖固定相 |
多糖手性固定相使得通常的色谱柱具有多用性和抗造性 |
|
生物分子色谱柱 |
创新的核壳结构和UHPLC大孔径固定相可以有效改善蛋白质和治疗性生物分子(如mAbs)的分析。 |
亚2 μm颗粒
1956年,Van Deemter就给出了使用非常小的颗粒进行快速、高效分离的预测。在过去五年中,典型填料的粒径在不断的减小,二十一世纪初,集中在亚2μm的硅微颗粒。正如预测的那样,这些粒子(例如,1.7μm)产生卓越的性能(~ 280000 plates/m或~ 4μm/plate)。然而,填充亚2μm粒子的色谱柱产生高的背压,通常填充内径为2.1毫米,通过粘性发热减少效率损失。对高压力和低分散(减少附加柱的谱带展宽)系统的要求导致了现代UHPLC系统的当前特点。进一步降低粒径至小于1.5μm可能会产生更高的速度和性能。然而,它也必须伴随着系统压力的大幅增加和毛细管色谱柱内径的减小。
核壳结构颗粒
Kirkland第一次描述了熔融的核或者核壳粒子的概念,减少质量转移过程中的阻力。第一个核壳粒子具有如下特点:2.7μm表面多孔硅材料,无孔的核心(1.7μm),多孔的壳层(厚0.5μm)。这些亚3 μm的颗粒与亚2μm的完全多孔材料相比似乎具有相似的效率,但是可以产生更低的压降。这种特殊的性能可能是由于壳体较短的扩散路径,或者比较狭窄的填料分布。由于快速分离(HIS、IPC和清洁验证)和在生物分子方面的应用,核壳色谱柱迅速获得广泛的接受。越来越多的制造商可以提供各种键合相和不同尺寸的粒子(1.3,1.7,2.6,1.3和5μm)。我们完全相信,与多孔微细颗粒的色谱柱相比,这些色谱柱在所有应用中具有很大的竞争力。
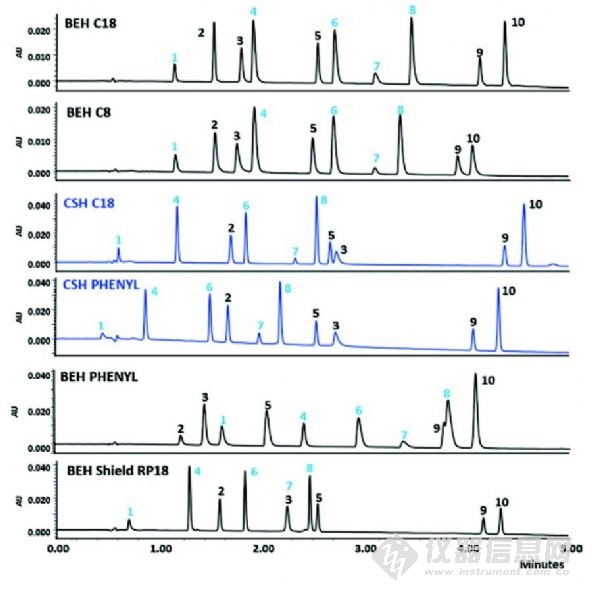
图4 10种具有酸性、碱性和中性官能团的商品化药物在BEH和CSH分析柱的分析比较,梯度洗脱,流动相含乙腈和0.1%的甲酸。峰1、4、6和8是基本药物。从文献中复印,已取得许可。
杂化
将有机基团引入到无机硅基体中形成杂交颗粒的理念在上世纪70年代首次由Unger提出,虽然第一根具有甲基基团的商业化的色谱柱在1999年才正式推出。这些混合物中的键合相被证明具有很好的pH稳定性(具有新奇的键合化学反应的pH范围为1到12,而传统的具有常规单功能键合硅颗粒的pH范围为2-8),低的亲硅羟基活性。2005年,引入第二代桥联乙烯杂化 (BEH),并立即获得了“主流”成功,特别是高pH值流动相以及UHPLC的应用方面。
新奇的键合反应
或许是因为批次之间重现性最好,传统的单官能团的C18硅胶基质键合相仍是主要的产品,但是新的键合化学反应给困难的分离(极性嵌入式、苯基、己基苯基、含氰基的、戊烷氟苯基键合)带来了更宽的pH值稳定范围(多官能的硅烷化学键或异丙基保护的硅烷)和增强的选择性。最近的一个创新方法称为表面带电杂化(CSH)技术,该项技术于2010年引入,由于在酸性,低离子强度流动相条件下,对高碱性分析物的峰形的改善,该项技术立即在药物分析领域获得了很好的接受度(如0.1%甲酸)。这项专有技术包括在固定相表面引入低水平的正电荷。这类似于早期在流动相中添加有机胺,如三乙胺,但由于离子抑制,已经不被LC/MS接受。图4说明了与现在的键合相相比,CSH颗粒在峰形方面表现的优势。注意,酸性化合物在CSH柱子上会有相对较高的保留,峰拖尾现象也会有所增加。
亲水作用色谱(HILIC)
在反相LC(RPLC)条件下,若流动相中有机物含量比较低,就会导致相坍塌现象(键合相脱水),许多强极性化合物就无法获得足够的保留时间或者会存在问题。HILIC模式, 90年代由Alpert首次开发,使用亲水固定相(硅、二醇、氰基、氨基、两性离子的),类似RPLC使用的水缓冲和乙腈流动相,在极性药物分析、辅助药物代谢、氨基酸、多肽、神经递质、低聚糖、碳水化合物、核苷酸或核苷方面的分析中越来越受欢迎。HILIC实际的保留机制可以认为是分析物分子“分区”到附着在亲水结合基团的水层。与RPLC相比,HILIC其他突出的优势包括“正交”选择性(样品制备兼容两种模式),对质谱具有更高的电喷雾离子化灵敏度(5-15倍),较低的操作压力。
固定化多糖手性固定相
成功包覆的多糖手性固定相(CSPs)的改进版本在2000年代末实现。与早期的CSPs具有相似的多功能,但是对于腐蚀性的溶剂具有更好的稳定性剂,可用于正相,极性有机和反相模式。
用于生物分子的色谱柱
80年代发展起来的大孔径硅和聚合物填料可有效解决大型生物分子的分离。随着重组蛋白,如单克隆抗体(mAb)等生物制药的出现,质量控制中利用HPLC和毛细管电泳进行详细表征的需求变得更加紧迫。最近,亚2μm微粒和核壳大孔径颗粒以及一些创新的离子交换和尺寸排阻等材料也被证明可以有效的分离这些大分子的生物制剂。
高分辨率质谱(HRMS),电雾式检测器(CAD)和自动方法开发系统(AMDS)
在过去十年中,其他具有高影响力的进展主要体现在HPLC检测和自动化领域。
高分辨率质谱(HRMS)
HPLC与质谱的联用(LC / MS),集合了HPLC的分离能力和质谱卓越的灵敏度和选择性,已被视为完美的分析工具。LC/MS是杂质和降解鉴定,药物研究中的高通量筛选技术(HTS),生物分析试验(生物流体中药物和代谢物的LC/MS/MS检测),药物合成工艺放大在线监测的首选技术。LC/MS已经成为高效药物清洁验证以及潜在的基因毒性杂质测定的标准技术平台。过去十年中,HRMS(如TOF、OrbiTrap MS)和杂化质谱(如Quadrupole-TOF或ion trap-OrbiTrap)得到了快速发展。HRMS和UHPLC以及二维LC的联用使得代谢组学、蛋白质组学, De Novo蛋白测序和生物制药表征等领域的研究愈发活跃。新兴的个性化医疗领域中生物标志物测定和疾病诊断的通用技术平台也许是LC/MS最令人兴奋的机会。
电雾式检测器(CAD)
缺乏理想的通用检测器常常被视为HPLC的局限,尽管UV/Vis检测器可以检测具有发色基团的化合物。示差折光检测器不适合梯度洗脱,敏感性不够。蒸发光散射检测器(ELSD)使用喷雾器技术与激光光散射检测,是HPLC的一个选择,也可以兼容梯度洗脱,但最近已经被CAD(使用喷雾器和电晕放电检测技术)超越,CAD可以提供更好的灵敏度(低至ng)和更好的线性。CAD正逐渐成为药物化学中的HTS、反应过程监控以及原材料/辅料测试的主流的检测器。
自动化HPLC方法体系(AMDS)
复杂混合物的HPLC方法开发是一个很耗时的工作,因为需要优化很多操作参数(柱尺寸,键合固定相和流动相A和B(有机溶剂/缓冲类型、pH值和离子强度)的类型,梯度洗脱时间和梯度范围,柱温度、流量)。一个常见的例子就是药物活性成分(API)稳定性指示分析或纯度测定,其中所有的杂质和降解产物必须分离,通过UV检测器进行准确的定量。多年以来,基于模拟、预测、单纯形优化、柱/流动相筛选的软件或自动化系统已经促进HPLC方法的开发。虽然他们似乎还没有很普及,但持续的改进提高了HPLC的性能和易用性。最新进入市场的是一个附加软件包,兼容两个常用的色谱数据系统。对于HPLC方法开发过程(优化)中最耗时的部分,该软件利用用户定义空间的自动化序列方法来解决,其中使用了实验设计(DoE)和质量源于设计(QbD)的原则。导入完整的序列结果之后,该软件还可以执行统计分析,并显示最佳条件。图5说明了应用在我们实验室的该软件的概念和特征。自DoE 和 QbD概念被接受以来,最初用户表现出很高的兴趣。AMDS对致力于早期药物开发方法的实验室特别有用。例如,为了支持利用多手性中心的复杂药物分子进行API合成和药物产品制造,10-20种具有代表性的HPLC方法(原材料、起始物料、中间体、最终的原料药和药物产品的非手性和手性方法,)接二连三地被开发出来。
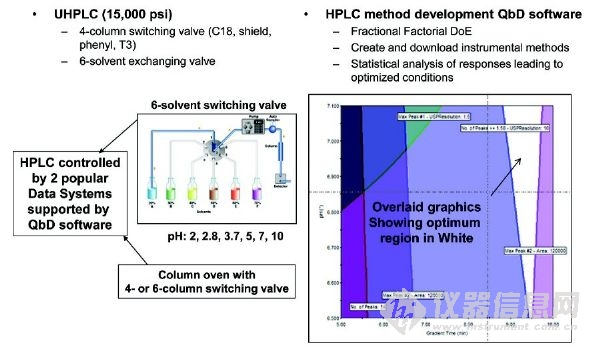
图5 一个全自动方法开发系统的仪器构造图解,该系统使用QbD软件和所得结果的图形,显示最佳分离(白色)的操作范围设计空间。
结论
总之, 最近几年中,HPLC仍然是一个高度有活力的领域,在仪器、色谱柱技术、应用等方面有很多创新。医药科学家们最初将这些新技术应用于研究、开发和质量控制,他们是这项技术的早期采纳者,同时也是受益者。UHPLC在研究与开发领域被快速的接受,并逐渐成为标准的UHPLC平台,虽然在QC实验室的应用速度慢一些。新的色谱柱技术可以更快和更有效的分析复杂样品、手性分子和生物分子。最后,UHPLC和2-D LC与高分辨率质谱联用技术的快速进展,已经彻底改变了生命科学的研究,并将会在临床诊断方面产生更大的影响。这些进展得到了在快速发展的药物开发领域工作的分析化学家的欢迎。
对于LC在接下来的几年的发展前景,一些创新的工作已经被描述。就像Jim Jorgenson描述的:“更高的压力(50000 psi)将使更小的颗粒和/或更长的色谱柱的使用成为可能,同时分离速度更快,效果也更好。由于热量的产生和耗散问题,几乎肯定的是需要使用sub-mm孔(毛细管)色谱柱。这并不是一件容易的事情,但是高速、高分辨率分离方面潜在的可能性是诱人的。”另外,在毛细管中填充极其均一的次微米二氧化硅粒子可以用来产生远低于1μm的塔板高度,并能对蛋白质变异体进行令人印象深刻的分离。这两个研究结果还没有准备好马上成为主流分析工作或QC,但是第一个结果是鼓舞人心的,因此在这里值得一提。
原文作者:Michael W. Dong, Ph.D.
Davy Guillarme, Ph.D.