

医学实验室通过ISO15189认可建立检测质量及技术管理体系,提高实验室质量管理水平,从而及时向患者和医护人员提供准确的检验结果,并指导多方面的运作。通过ISO15189认可可提高医学实验室质量管理水平。新标准以风险管理为基础,以患者为中心,鼓励医学实验室持续改进。在标准文件的要求中,处处体现确保患者风险是医学实验室质量管理设计和流程核心的精神。

▶新标准编写框架上与修订后的ISO9001:2015一致,遵循了类似结构,并在附件中与ISO9001:2015进行了比较。
▶章节结构方面由原来的5章改为8章。
▶纳入新的引用文件涉及安全、风险、MU、溯源、EQA、RM、POCT等。
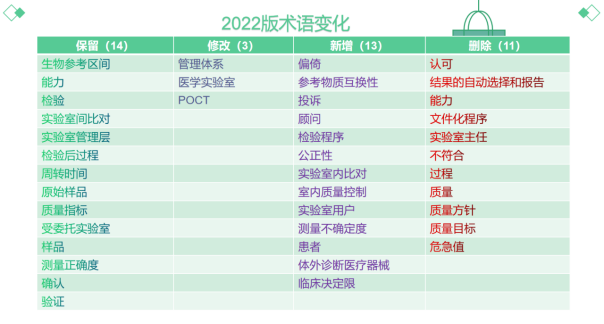
▶术语方面保留了14个术语,修改3个,新增13个,删除了11个。
▶通用要求更加具体并强化。
▶结构和管理要求中取消了“质量主管”的称谓;不再要求必须编制“质量手册;强调“风险管理”相关要求。
▶资源要求方面区分了设备校准和项目校准;将床旁检验(POCT)纳入了标准
▶过程要求增加了“连续性和应急准备计划”条款,针对实验室遇到紧急情况时的措施和要求,以确保实验室能够恢复正常工作
▶通过策划和实施应对风险的措施,强化对患者福利的关注,最终目的是保证患者的健康和安全。

与ISO15189∶2012相比,ISO 15189:2022的结构发生很大变化,除第1章范围、第2章规范性引用文件和第3章术语定义外,其余章节条款均重新进行了编排。总章节从原来的五章改为八章。


▶增加引用ISO 17511《体外诊断医疗器械 建立校准品、正确度控制物和人样品赋值的计量学溯源性要求》及GB/T《医学实验室 样品采集、运送、接收和处理的要求》(等同采用ISO/TS 20658);
▶删除原文件第2章中引用的GB 19781和WS 233;原第2章引用的CNAS-GL028删除,修改为WS/T 807《临床微生物培养、鉴定和药敏检测系统的性能验证》
▶删除《病理科建设与管理指南(试行)》(卫办医政发〔2009〕31号)


通用要求更具体并强化

4.1公正性和4.2保密性作为ISO对合格评定类标准的固定格式要求,新版这两项内容的要求更加具体并强化;
4.3与患者相关的要求专门明确了9项具体与患者诊疗相关的要求。
结构和管理要求方面加入风险管理

主要变化包括概述“实验室主任”的职责而不再罗列具体要求;取消了“质量主管”的称谓,但仍规定其相关职责;不再要求必须编制“质量手册;强调“风险管理”相关要求,强化了风险管理在整理组织管理中的作用。
区分了设备校准和项目校准将床旁检验(POCT)纳入了标准

资源要求方面将6.5.2设备和方法的计量学溯源和6.5.3测量结果的计量学溯源进行了区分,区分了设备校准和项目校准;服务协议方面纳入了POCT的要求。原来的POCT是一个独立的标准,但是新版修订以后,POCT的要求直接纳入到ISO15189的标准里。专业对由实验室提供支持的POCT活动的协议进行了规定,并有多学科组织的POCT委员会管理此类服务协议。此外,新标准发布后,ISO 22870《医学实验室POCT的要求》将废止。
过程要求

不再要求评估不符合的程度,室间质评要求增加包括POCT检验方法,对实验室投诉更加具体明确,新增加“连续性和应急准备计划”条款:
针对实验室遇到紧急情况时的措施和计划,以确保实验室能够恢复正常工作,包括:制定紧急情况的应对计划;
向实验室人员提供信息和培训;
对实际的紧急情况进行响应;
采取措施防止或降低紧急情况的后果
管理体系要求中特别强调风险管理

标准中有5.6和8.5两个单独条款规定风险管理要求,有近20处提及风险管理相关要求,在5.6风险管理中强调“风险管理”相关要求,强化了风险管理在整体组织管理中的作用。新增8.5“风险和改进措施”条款,再次突出风险管理的要求,取消“预防措施”要素,相关要求融入风险评估过程。要求更具体明确,包括:风险和改进机会识别:
1)防止或降低不利影响和潜在故障;
2)利用机会改进;
3)确保管理体系达到预期结果;
4)降低患者照护风险;
5)达到试验室目的和目标。
声明:本文所用视频、图片、文字部分来源于互联网,版权属原作者所有。如涉及到版权问题,请及时和我们联系,核实后协商处理或删除。